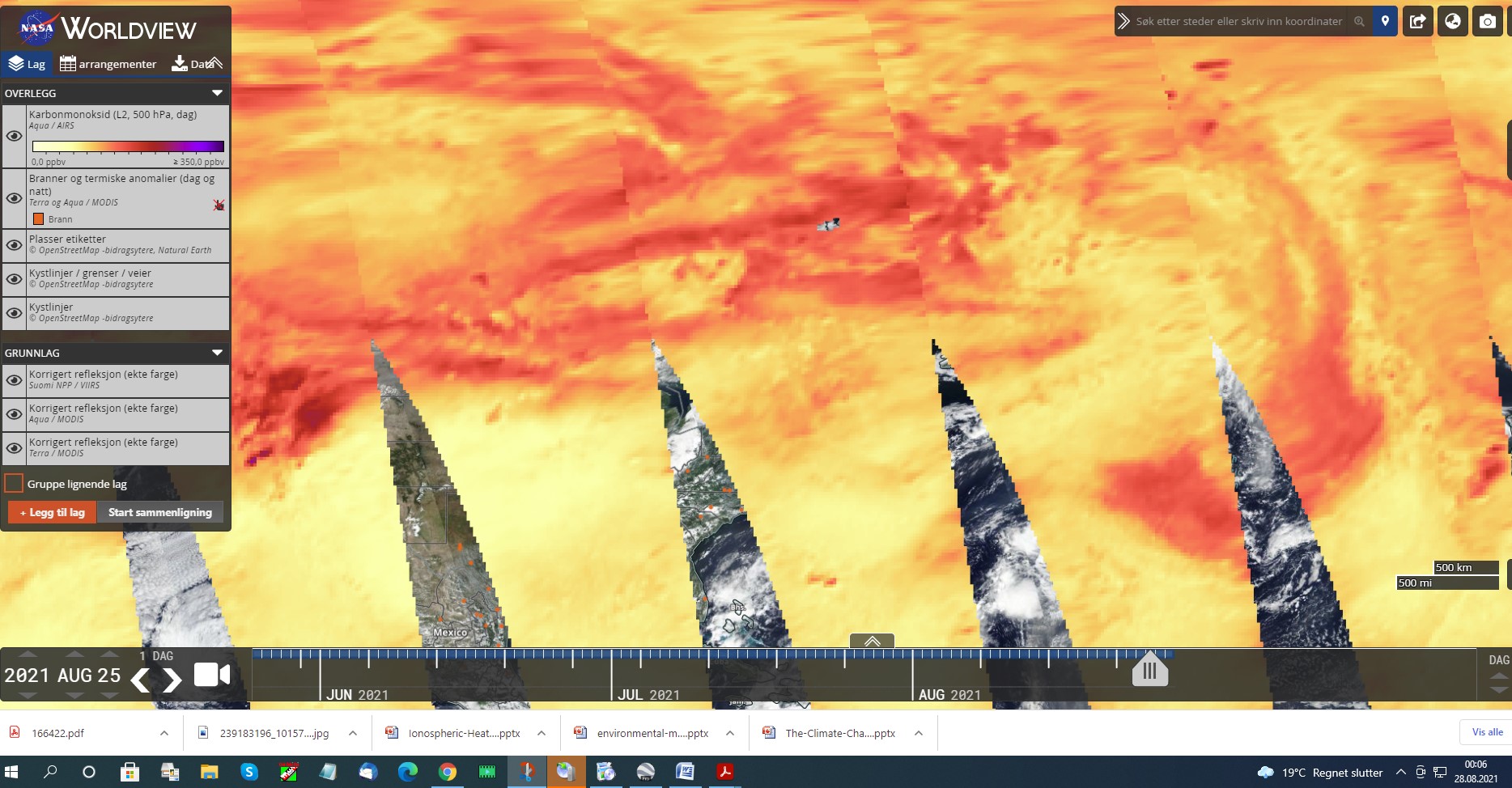
25.08 2021
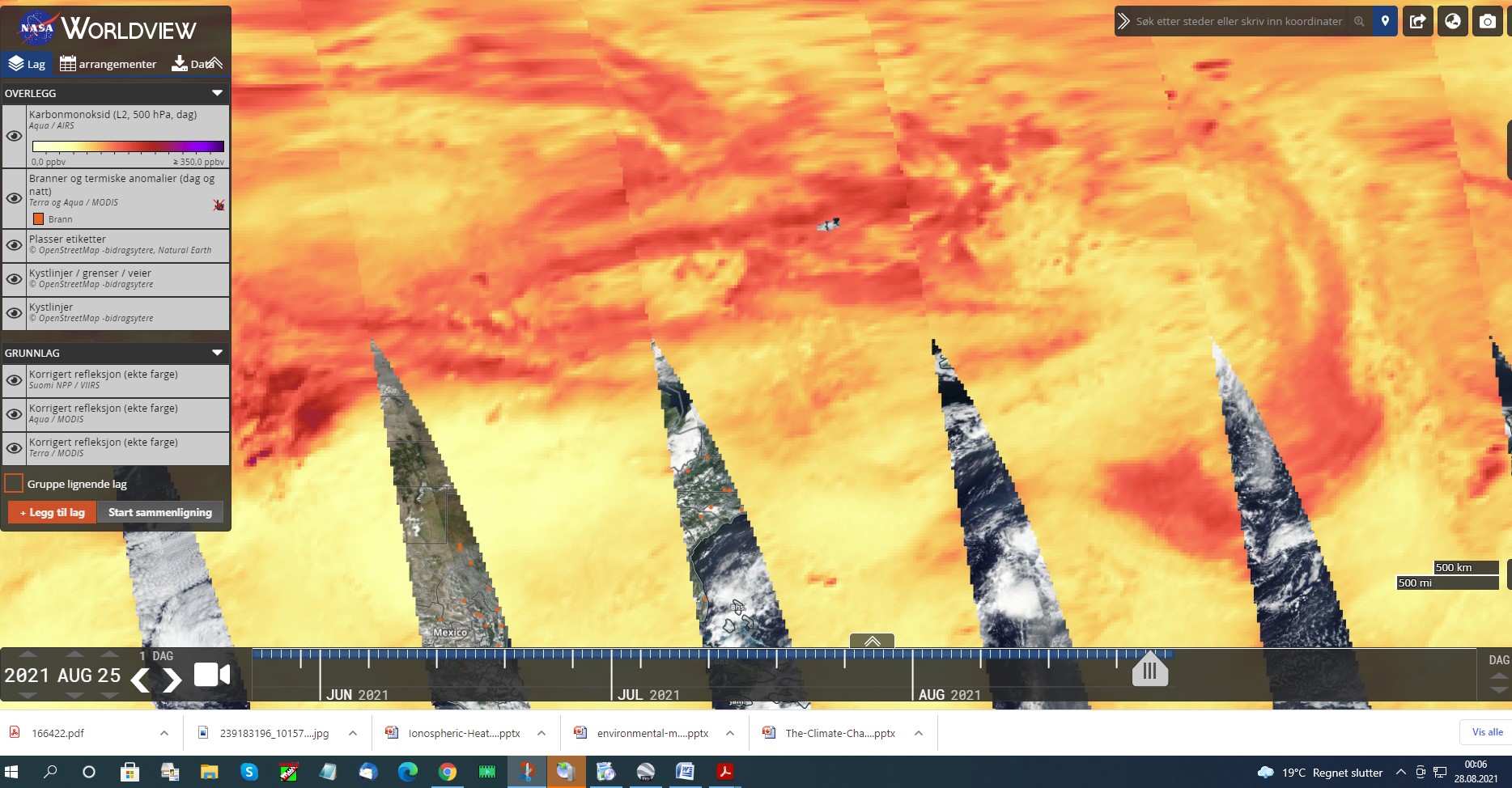
26.08 2021
27.08 2021
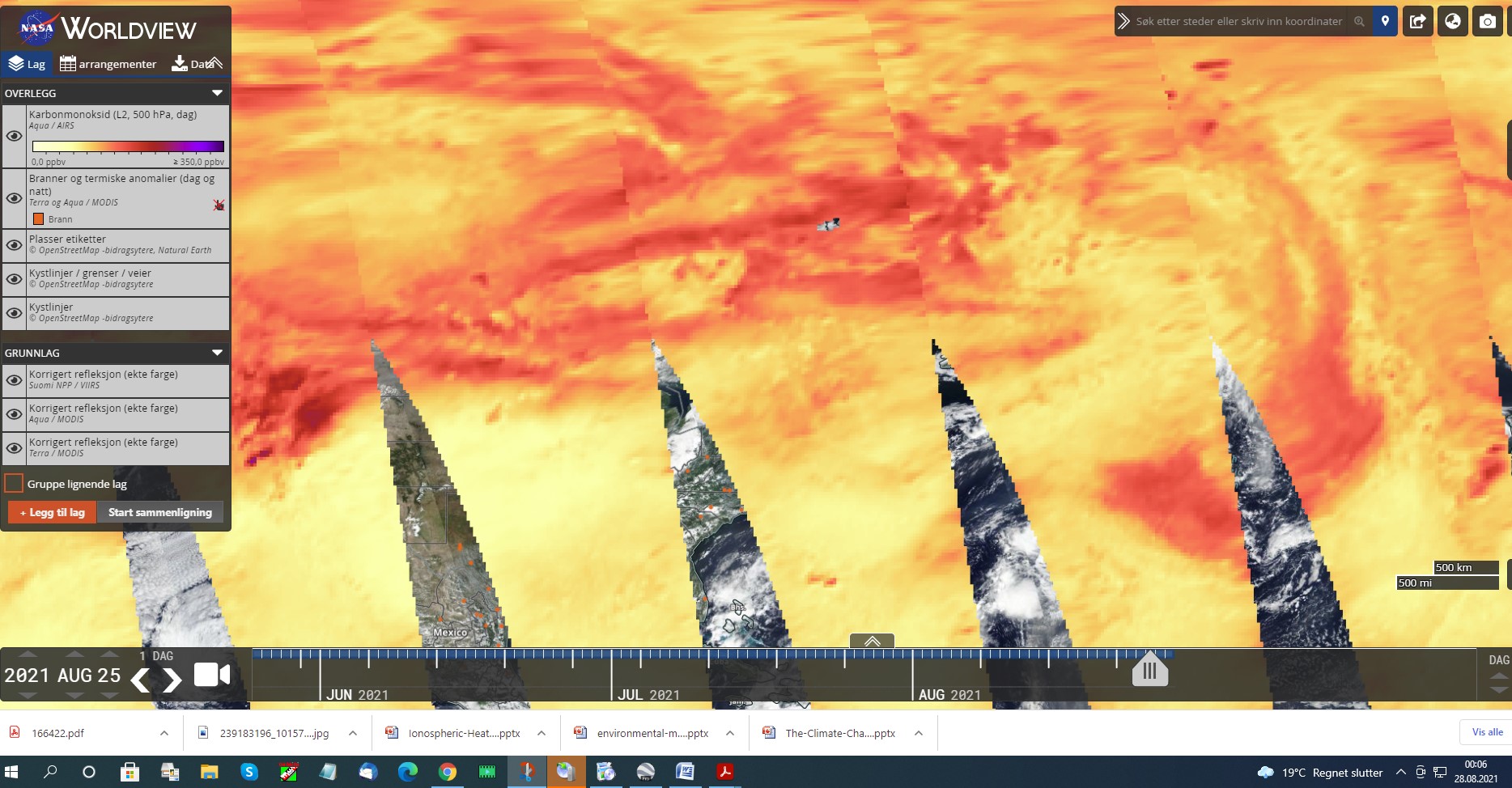
DET SNAKKES MYE OM CO2. DISSE BILDENE ER TATT AV SATELITTER OG SOM VISER AT CO2 FINNES I ATMOSFÆREN. IFLG KLIMAFORSKERE OA KLIMAEKSPERTER SÅ SKAL DETTE VÆRE PGA KLIMAUTSLIPP FRA JORDA. DERSOM MAN SER PÅ PERIODESYSTEMET FINNER MAN UT FØLGENDE VED Å SE PÅ MOLVEKTEN SOM JEG VIL KOMMENTERE SIST I INNLEGGET.
FØRST LITT OM KARBONDIOKSID.
Karbondioksid er en kjemisk forbindelse. Den er viktig for klimaet på Jorden og for grønne planter. Den kjemiske formelen er CO2.
Faktaboks
UTTALE karbˈondioksˈid
Ved romtemperatur er karbondioksid en fargeløs gass med svak syrlig lukt og smak. Under –57 grader celsius (°C) kondenserer gassen til en væske som ved –78 °C fryser til et fast stoff, kalt tørris.
Karbondioksid dannes ved forbrenning i kroppen til mennesker og dyr, og ved andre forbrenningsprosesser.
I fotosyntesen reduseres karbondioksidgass og vann av grønne planter og sollys til oksygengass og karbohydrater.
Karbondioksid løser seg lett i vann og danner karbonsyre, tidligere kalt kullsyre.
Egenskaper

Den kjemiske formelen for karbondioksid er CO2. Molekylet er lineært, og strukturformelen er O=C=O.
Karbondioksidmolekylet er meget stabilt. Først ved temperaturer over 2000 °C spaltes det i karbonmonoksid og oksygen. Reaksjonsligningen for denne prosessen er
2CO2(g) –› 2CO(g) + O2(g)
Karbondioksid er lett løselig i vann. Mesteparten er i form av molekylet, bare cirka 0,2 prosent i form av karbonsyre (H2CO3).
Løst i vann gjør det at vannet blir sprudlende og får en frisk smak, og det blir derfor brukt som tilsetning i brus og kunstig mineralvann.
Ved høyt trykk og høy temperatur har man greid å fremstille kvartslignende stoffer, carbonia, fra karbondioksid.
Forekomst
Karbondioksid forekommer både i fri og bundet tilstand i naturen. I gjennomsnitt inneholder luft rundt 400 deler per million (ppm) karbondioksid (2017), og mengden er stigende. 400 ppm vil si at det er fire karbondioksidmolekyler blant 10 000 molekyler i luften.
Hydrosfæren, det vil si alt flytende og fast vann på jordoverflaten, inneholder cirka 50 ganger så mye karbondioksid som det er i luften. Mange mineralkilder inneholder betydelige mengder karbondioksid. Flere steder, særlig i nærheten av vulkaner, strømmer karbondioksid ut av revner og sprekker i jorden.
Karbondioksid dannes ved forbrenning av ved, kull, koks og petroleum under tilstrekkelig oksygentilførsel. Også ved forbrenningsreaksjoner i vår organisme dannes karbondioksid. Den forlater kroppen gjennom utåndingsluft, som har et CO2-innhold på om lag fire prosent.
Spormengder av karbonisotopen 14C vil i atmosfæren foreligge i form av 14CO2. Metabolisme av 14CO2 av levende organismer kan brukes til radioaktiv aldersbestemmelse av karbonholdig materiale.
Kjemisk bundet CO2 finnes i mange naturlig forekommende karbonater, fremfor alt i form av kalkstein.
Egenskaper
Gass
Karbondioksid er ikke brennbar og underholder heller ikke forbrenningen. Et brennende lys vil slukne i karbondioksid, og CO2 kan derfor brukes som brannslukningsmiddel.
Tettheten av karbondioksidgass er 1,5 ganger større enn luftens, så gassen samler seg på bunnen i rom der det utvikles slik gass, for eksempel i grotter og kjellere. Kjent er Hundegrotten i Napoli, der det nederste gasslaget (50 centimeter over bunnen) inneholder omtrent 70 prosent karbondioksid, noe små dyr som hunder ikke kan leve i. Mennesker som går oppreist, vil derimot kunne puste uhindret.
Væske
Karbondioksidgass lar seg lett kondensere til væske. Kritisk temperatur og trykk er henholdsvis 31,0 °C og 75,3 standard atmosfærer (atm). Ved 20 °C blir CO2 flytende under et trykk på 56,5 atm.
Flytende CO2 er en fargeløs, lett bevegelig væske. Ved et ytre trykk på 5,2 atm vil væsken fryse ved −56,6 °C til en islignende masse. (For trippelpunktet for karbondioksid, se fasediagram). Ved atmosfæretrykk finnes derimot ingen væskefase, og fast CO2 sublimerer ved –78,5 °C, det vil si at det går direkte over i gassfase.
Karbondioksid kan derfor bare fås i flytende tilstand under overtrykk. I denne formen kommer det i handelen fylt på stålflasker. Åpner man ventilen på en slik flaske, fordamper det flytende karbondioksidet under stort varmeforbruk, temperaturen synker til sublimasjonspunktet –78,5 °C, og det oppstår en snølignende masse som i presset tilstand kalles tørris.
Ved temperatur og trykk høyere enn kritisk har karbondioksid form av en superkritisk væske. Den brukes til ekstraksjon av koffein fra kaffebønner ved fremstilling av koffeinfri kaffe og også mange andre stoffer fra andre kilder.
Løst i vann
Karbondioksid er lett løselig i vann. Løseligheten skjer med økende trykk og avtagende temperatur. Ved 15 °C og 1 atm løser 1 liter vann 1 liter CO2, ved 0 °C løser det 1,7 liter CO2. Karbondioksid gir vannet en frisk smak og blir derfor brukt som tilsetning i leskedrikker.
Løsninger av CO2 i vann reagerer svakt surt, som nevnt ovenfor. Når CO2 ledes inn i kalkvann (se kalsiumhydroksid), dannes bunnfall av kalsiumkarbonat:
CO2(g) + Ca2+(aq) + 2OH–(aq) –> CaCO3(s) + H2O(l) [reaksjonsligning]
Vi sier at karbondioksid blakker kalkvann, og slik felling brukes til kvalitativ påvisning av CO2.
Fremstilling
I laboratoriet fremstilles karbondioksid ved å sette saltsyre til kalsiumkarbonat:
CaCO3(s) + 2H3O+(aq) -> CO2(g) + Ca2+(aq) + 3H2O(l)
Ved mange industrielle prosesser dannes store mengder CO2 som slippes ut i atmosfæren. Handelsproduktet blir for eksempel fremstilt ved fullstendig forbrenning av kull, koks, petroleum og naturgass i luft:
C(s) + O2 (g) -> CO2(g)
CO2 fås også som biprodukt ved kalkbrenning, i fremstilling av ammoniakk og i gjæringsprosesser.
Store mengder karbondioksid blir brukt til fremstilling av soda, urea, blyhvitt, bariumkarbonat med mer. I løst tilstand finner man CO2 i øl, mineralvann og andre leskedrikker, i musserende vin med mer. I flytende tilstand brukes det i kuldemaskiner og brannslukkere, og i fast tilstand som tørris.
Karbondioksid har dessuten anvendelse som inert gass ved kjemiske prosesser, i veksthus som tilsetning til luften, i gasslasere med mer.
Tilsetningsstoff
Som tilsetningsstoff har karbondioksid E-nummer E290. Gassen brukes i brus, mineralvann og øl og er tillatt i alle matvarer. Den brukes også som pakkegass for å øke holdbarhet på en del plastpakkede produkter, se konservering.
Fysiologisk virkning
Celler hos mennesker produserer hele tiden CO2, og en viss mengde CO2 vil derfor hele tiden være løst i blodet. Det meste av den produserte CO2-en luftes ut igjennom lungene. Normalområdet er 4,5–6 kilopascal (kPa) (se blodgasser).
- Les mer om karbondioksid – fysiologi
Hvis CO2-konsentrasjonen i luften som pustes inn er høyere enn CO2-nivået i blodet, er det fare for at CO2-nivåene i blodet vil stige til tilsvarende nivå. Høye CO2-nivåer i blodet (typisk over 8 kPa) vil over tid, avhengig av personens medisinske tilstand, kunne medføre bevisstløshet og et dårligere pustemønster. Personen kommer inn i en negativ spiral der økende CO2 hemmer pustemønsteret enda mer, og det utvikles en såkalt CO2-narkose (karbondioksidnarkose) som er dødelig hvis den ikke behandles. Behandlingen vil være såkalt assistert ventilasjon, altså en form for pustehjelp der lungene ventileres kontrollert for å få CO2 ut av blodet.
For lave nivåer av CO2 i blodet er også uheldig, da dette blant annet kan redusere blodsirkulasjonen til hjernen.
CO2-nivået i blodet påvirker blodets surhetsgrad (pH-verdi) direkte, og det kan være uheldig med både for høye og for lave verdier. Det er ikke farlig å drikke væsker som inneholder CO2, for eksempel brus, da CO2 i mage- og tarmsystemet ikke nevneverdig vil tas opp i kroppen.
Alkoholholdige drikkevarer som inneholder CO2, virker hurtigere berusende enn tilsvarende CO2-frie drikkevarer.
CO2-balansen
Av grunnleggende betydning for alt liv på Jorden er det kretsløpet karbondioksid gjennomløper fra den døde naturen til den levende naturen og derfra tilbake til den døde naturen, særlig gjennom fotosyntesen hos grønne planter og åndedrettet hos levende organismer.
Fotosyntesen fører til at karbondioksid bindes i form av organiske forbindelser, og åndedrettet fører til frigjøring av karbondioksid. Alt i alt regner man med at fotosyntesen trekker cirka 60 milliarder tonn CO2 ut av luften per år, og at den samme mengden føres tilbake ved åndedretts- og forråtnelsesprosesser.
Det er nesten likevekt mellom mengden karbondioksid som tilføres atmosfæren ved naturlige prosesser og mengden som fratas den. Hydrosfæren avgir årlig rundt 100 milliarder tonn CO2 til atmosfæren, og omtrent like mye gir atmosfæren tilbake til hydrosfæren. Cirka 100 millioner tonn CO2 blir årlig tatt opp fra atmosfæren på grunn av forvitringsprosesser som fører til karbonatdannelse, og omtrent den samme mengden strømmer årlig ut fra vulkaner, karbondioksidkilder og annet.
JORDAS UTSLIPP AV CO2:
HER SKAL JEG TA FOR MEG PERIODESYSTEMET FOR GRUNNSTOFFER OG SPESIELT C(KARBON) OG O(OKSYGEN).
UT FRA PERIODESYSTEMET TAR VI FOR OSS DEN RELATIVE MOLEKYLVEKTEN:
SIDEN FORMELEN FOR KARBONDIOKSID ER CO2 VIL DA DEN RELATIVE MOLEKYLVEKTEN VÆRE for C 12.01 g/mol(SE PERIODESYSTEMET)
O= OKSYGEN HAR 2 LIKE ATOMER…DERAV O2 SOM HAR EN RELATIV MOLEKYLVEKT 15.99x 2 g/mol
MAO VIL MOLEKYLVEKTEN AV CO2 VÆRE 12.01+15.99X2 = 44.01 g/mol
HVA SIER DET OSS? ETTER HVA JEG SKJØNNER SÅ ER DET KOMPLETT UMULIG AT CO2 UTSLIPP PÅ JORDA IKKE KAN NÅ EN HØYDE I ATMOSFÆREN SOM VISES PÅ KARTENE. IHVERTFALL IKKE I DEN GRAD SOM FORSKNINGEN SIER. AT DET FINNES CO2 I ATMOSFÆREN JA……MEN IKKE I DEN MENGDEN SOM DET PÅSTÅES.
CO2 KAN VÆRE GIFTIG MEN KONSENTRASJONEN I LUFTEN ER LANGT FRA NOK TIL AT DET ER SKADELIG. MAO SÅ ER DETTE HVA KLIMAHYSTERIKERNE HEVDER ANG DET LILLE AV UTSLIPP AV CO2 I NORGE ER DIREKTE FEIL. DET ER UTROLIG AT IKKE BLA CICERO OG BJØRKNES SIER NOE OM DETTE. DEN ENESTE SOM HAR FORKLART DETTE ER GIEVER MEN SOM SIKKERT HAR FÅTT MUNNKURV. OG HVA MED KJEMIKERE…HØRER MAN NOE FRA DE? NOPE!
MIN KONKLUSJON BLIR DA. AT UT FRA KARTET SOM VISER STORE MENGDER CO2 VERDIER SÅ MÅ ATMOSFÆREN HA FÅTT TILFØRT CO2 OG DA VED SPRAYING FRA FLY…BALLONGER OG RAKETTER I STOR HØYDE OPP MOT 60.000 FT ELLER 18.000M. OG DET HAR JEG VIST DOKUMENTASJONER PÅ I FB GRUPPA OG BLOGGEN(NETTSTEDET














+ There are no comments
Add yours